Tartalom
- Fő különbség
- Összehasonlító táblázat
- Mik az ionos vegyületek?
- Mik a molekuláris vegyületek?
- Ionos vegyületek és molekuláris vegyületek
Fő különbség
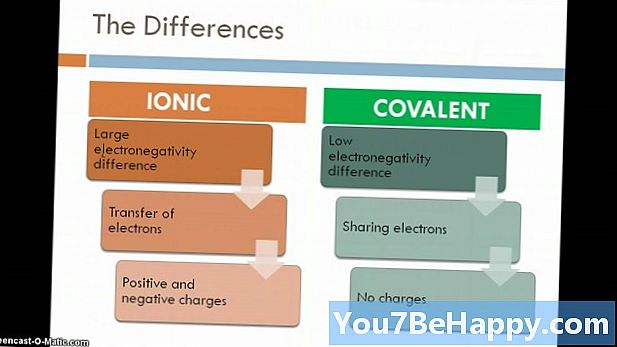
A vegyületet olyan anyagnak tekintik, amely akkor képződik, ha két vagy több elem meghatározott arányban egyesül kémiai kötésen keresztül. Az ionos vegyület az a vegyület, amely a fémek és a nemfémek közötti elektrosztatikus vonzóerő miatt képződik. Az ionos vegyületek általában értékesített kristályos állapotban jelennek meg. Ezen túlmenően az ionos vegyületek jó villamos vezetők, magas olvadási és forrásponttal rendelkeznek. Másrészt, molekuláris vegyületek képződnek az elektronok megoszlása következtében két nemfémek között. Az ionos vegyületekhez viszonyítva alacsony áramvezető képességgel bírnak, alacsony olvadási és forráspontúak.
Összehasonlító táblázat
| Ionos vegyületek | Molekuláris vegyületek | |
| Képződés | Ionos vegyületek képződnek a fémek és a nemfémek közötti elektrosztatikus vonzóerő miatt. | A molekuláris vegyületek az elektronok két nemfémek közötti megosztása miatt képződnek. |
| Csoport | Ionos vegyületek képződnek fém és nem mentális között. | Molekuláris vegyületek akkor képződnek, amikor két nemfémet kémiailag kombinálnak |
| Kötvény | Az ionos vegyület az ionos kötésnek nevezett elektrosztatikus vonzóerő miatt képződik. | A molekuláris vegyületek az elemek közötti kovalens kötés miatt képződnek. |
| Olvadáspont és forráspont | Magas | Alacsony |
| Állapot | Az ionos vegyületek mindig szilárd állapotban vannak, és kristályos megjelenést mutatnak. | A molekuláris vegyületek bármilyen állapotban lehetnek, szilárd, folyékony vagy gázosak szobahőmérsékleten. |
| Villamos energia vezetője | Jó | Rossz |
Mik az ionos vegyületek?
Ezek a vegyületek a fémek és a nemfémek közötti elektrosztatikus vonzóerő miatt képződnek. Egyszerűbben fogalmazva: az ebben levő erő (ionos kötés) pozitív és negatív töltésű reakciókat eredményez, hogy vegyületet képezzenek. Az ionos vegyületek általában értékesített kristályos állapotban jelennek meg, és jó villamos vezetők, magas olvadási és forrásponttal rendelkeznek. Az ionos vegyületek fémek és nemfémek között képződnek, és valamilyen fényes megjelenésűek.
Példa: Asztali só (NaCl) az ionos vegyület leggyakoribb példája. Ebben a kialakulásban a nátrium (NA) fém, míg a klór (Cl) nem fém, mindkettőjük együtt van tartva, mivel mindkettő köztük az elektrosztatikus vonzóerő hat.
Mik a molekuláris vegyületek?
A nemfémek közötti elektronok megosztásának eredményeként képződött vegyületeket molekuláris vegyületnek nevezzük. Az itt reagáló elemek együtt vannak tartva a kovalens kötés miatt, és ezért ezeket a vegyületeket gyakran nevezik kovalens vegyületeknek.Az ionos vegyületekhez viszonyítva alacsony áramvezető képességgel bírnak, alacsony olvadási és forráspontúak.
Példa: Az ózonban (O3) az oxigén az elektronok megosztásával ötvözi az ózonot.
Ionos vegyületek és molekuláris vegyületek
- Ionos vegyületek képződnek a fémek és a nemfémek közötti elektrosztatikus vonzóerő miatt, míg a molekuláris vegyületek az elektronok megoszlása következtében két nemfémet tartalmaznak.
- A molekuláris vegyületek akkor képződnek, amikor két nemfémet kémiailag kombinálnak, másrészt az ionos vegyületek a fém és a nem mentális között képződnek.
- A molekuláris vegyületek az elemek közötti kovalens kötés miatt képződnek, míg az ionos vegyületek az ionos kötésnek nevezett elektrosztatikus vonzóerő miatt képződnek.
- A molekuláris vegyületek alacsony olvadáspontú és forráspontúak, mint az ionos vegyületek.
- A molekuláris vegyületek bármilyen állapotban lehetnek, szilárd, folyékony vagy gázosak szobahőmérsékleten, míg az ionos vegyületek mindig szilárd állapotban vannak, és kristályos megjelenést mutatnak.
- A molekuláris vegyületek rosszul vezetnek villamos energiát, míg az ionos vegyületek jó elektromos vezetést mutatnak.


