Tartalom
-
proteoglikánok
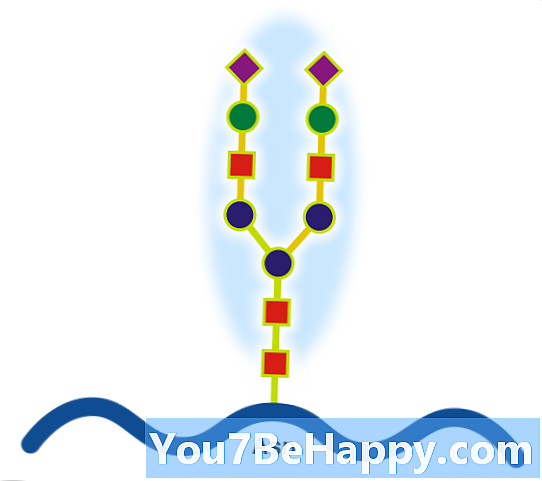
A proteoglikánok olyan proteinek, amelyek erősen glikozilezve vannak. Az alapvető proteoglikán egység "magfehérjéből" áll, egy vagy több kovalensen kapcsolt glikozaminoglikán (GAG) lánccal. A kapcsolódási pont egy szerin (Ser) maradék, amelyhez a glikozaminoglikánt egy tetraszacharid-hídon keresztül kapcsolják össze (például kondroitin-szulfát-GlcA-Gal-Gal-Xil-PROTEIN). A Ser-maradék általában a -Ser-Gly-X-Gly- sorozatban van (ahol X jelentése bármilyen aminosavmaradék lehet, de prolin), bár nem minden ilyen fehérjével rendelkezik kapcsolt glikozaminoglikán. A láncok hosszú, egyenes szénhidrát polimerek, amelyek fiziológiás körülmények között negatív töltésűek a szulfát- és uronsavcsoportok előfordulása miatt. A proteoglikánok a kötőszövetben fordulnak elő.
-
glikoprotein
A glikoproteinek olyan fehérjék, amelyek oligoszacharid láncokat (glikánokat) tartalmaznak kovalensen kapcsolódva az aminosav oldalláncokhoz. A szénhidrátot a fehérjéhez kotranszlációs vagy poszttranszlációs módosítással kapcsolják hozzá. Ezt a folyamatot glikozilezésnek nevezik. A szekretált extracelluláris fehérjék gyakran glikoziláltak. Azokban a fehérjékben, amelyeknek szegmensei extracellulárisan kiterjednek, az extracelluláris szegmenseket szintén gyakran glikozilálják. A glikoproteinek gyakran fontos szerves membránfehérjék is, amelyek szerepet játszanak a sejt-sejt kölcsönhatásban. Fontos megkülönböztetni a szekréciós rendszer endoplazmatikus retikulum-alapú glikozilációját a reverzibilis citoszol-nukleáris glikozilezéstől. A citoszol és a sejtmag glikoproteineit módosíthatjuk egyetlen GlcNAc maradék reverzibilis hozzáadásával, amelyet a foszforilációval kölcsönösen kölcsönösnek tekintünk, és ezek funkciói valószínűleg további szabályozási mechanizmusok, amelyek a foszforiláción alapuló jelátvitelt szabályozzák. Ezzel szemben a klasszikus szekréciós glikozilezés szerkezetileg nélkülözhetetlen lehet. Például az aszparaginhoz kapcsolt, azaz az N-kötésű glikozilezés gátlása megakadályozhatja a megfelelő glikoprotein-hajtogatást, és a teljes gátlás mérgező lehet az egyes sejtekre. Ezzel szemben a glikán feldolgozása (az enzimatikus eltávolítás / a szénhidrát maradékok hozzáadása a glikánhoz), amely mind az endoplasztikus retikulumban, mind a Golgi készülékben előfordul, nélkülözhetetlen az izolált sejtek számára (a glikozid gátlókkal való túlélés bizonyítékaként), de emberre vezethet betegség (a glikozilezés veleszületett rendellenességei) és állati modellekben halálos lehet. Ezért valószínű, hogy a glikánok finom feldolgozása fontos az endogén funkciók szempontjából, például a sejtek kereskedelme szempontjából, de ez valószínűleg másodlagos jelentőségű a gazda-patogén kölcsönhatásokban betöltött szerepében. Ez utóbbi hatás híres példája az ABO vércsoport-rendszer.
Proteoglikánok (főnév)
több proteoglikán
Glikoprotein (főnév)
Kovalensen kötött szénhidrátokkal rendelkező protein.
Glikoprotein (főnév)
bármely olyan fehérjekategória, amelynek szénhidrátcsoportjai kapcsolódnak a polipeptidlánchoz.
Glikoprotein (főnév)
egy szénhidrátkomponenst tartalmazó konjugált protein